Миелофиброз (МФ) — это опухолевое заболевание костного мозга, относящееся к группе миелопролиферативных заболеваний. Это хроническое заболевание, при котором в костном мозге происходит ненормально сильный фиброзный процесс (образование волокнистой соединительной ткани), вследствие которого снижается площадь костного мозга, вырабатывающего нормальные клетки крови. МФ может возникнуть у пациента сам по себе (первичный миелофиброз) или же в том случае, когда ранее у пациента уже диагностировали какое-то другое заболевание костного мозга (например, истинную полицитемию или эссенциальную тромбоцитемию). Однако лечение зависит не только от того, как возникла болезнь.
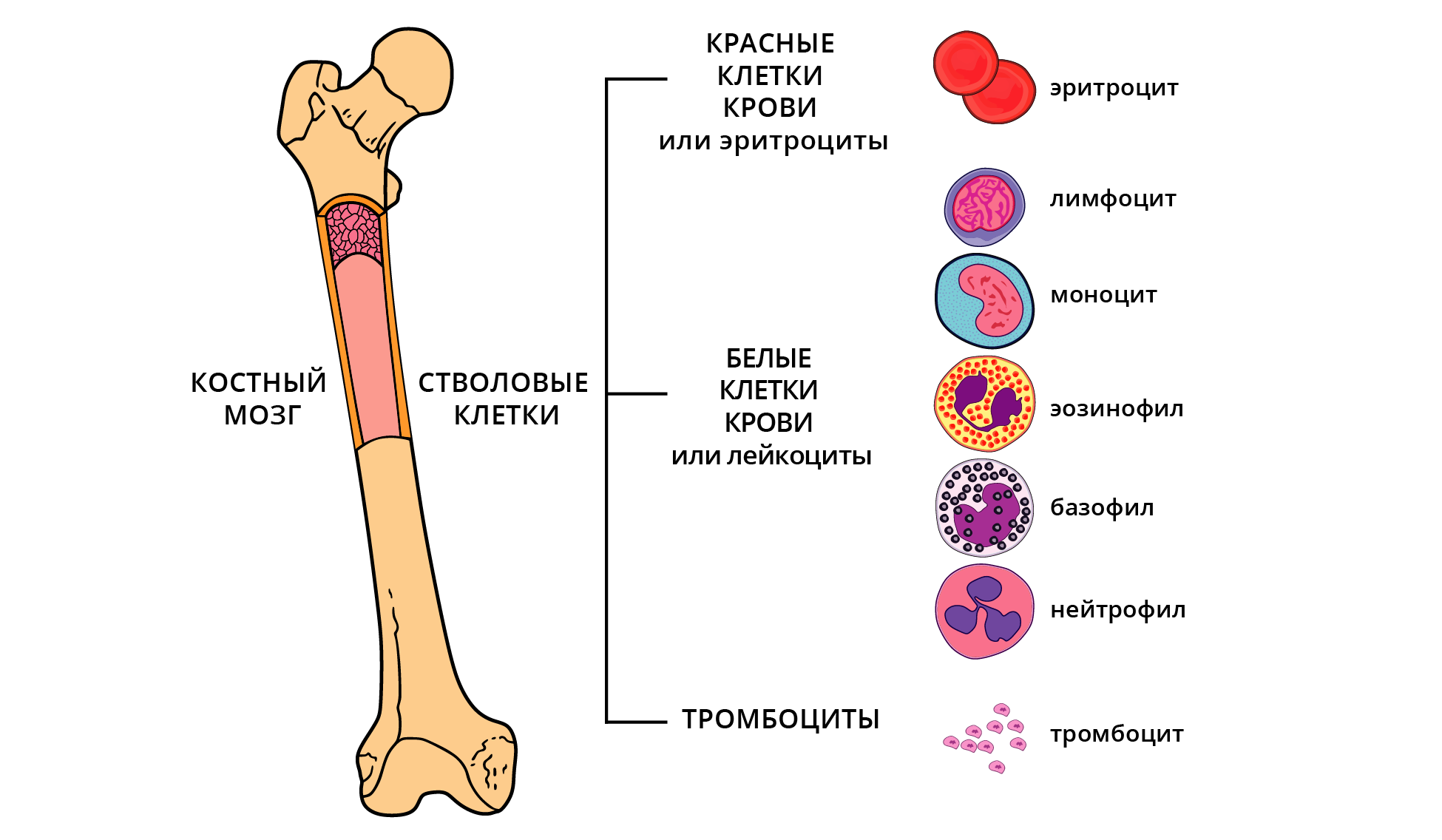
МФ — это редкое заболевание. За год диагностируется в среднем 1,5 случая на 100 000 человек. Диагноз ставится по результатам анализа крови, гистологического исследования костного мозга и ультразвукового исследования брюшной полости.
Причиной МФ является изменение в стволовых клетках костного мозга. Недавно ученые обнаружили изменения в ДНК, в результате которых нарушается нормальная регуляция кроветворения и определенные клетки вырабатываются в большем количестве, чем это требуется организму.
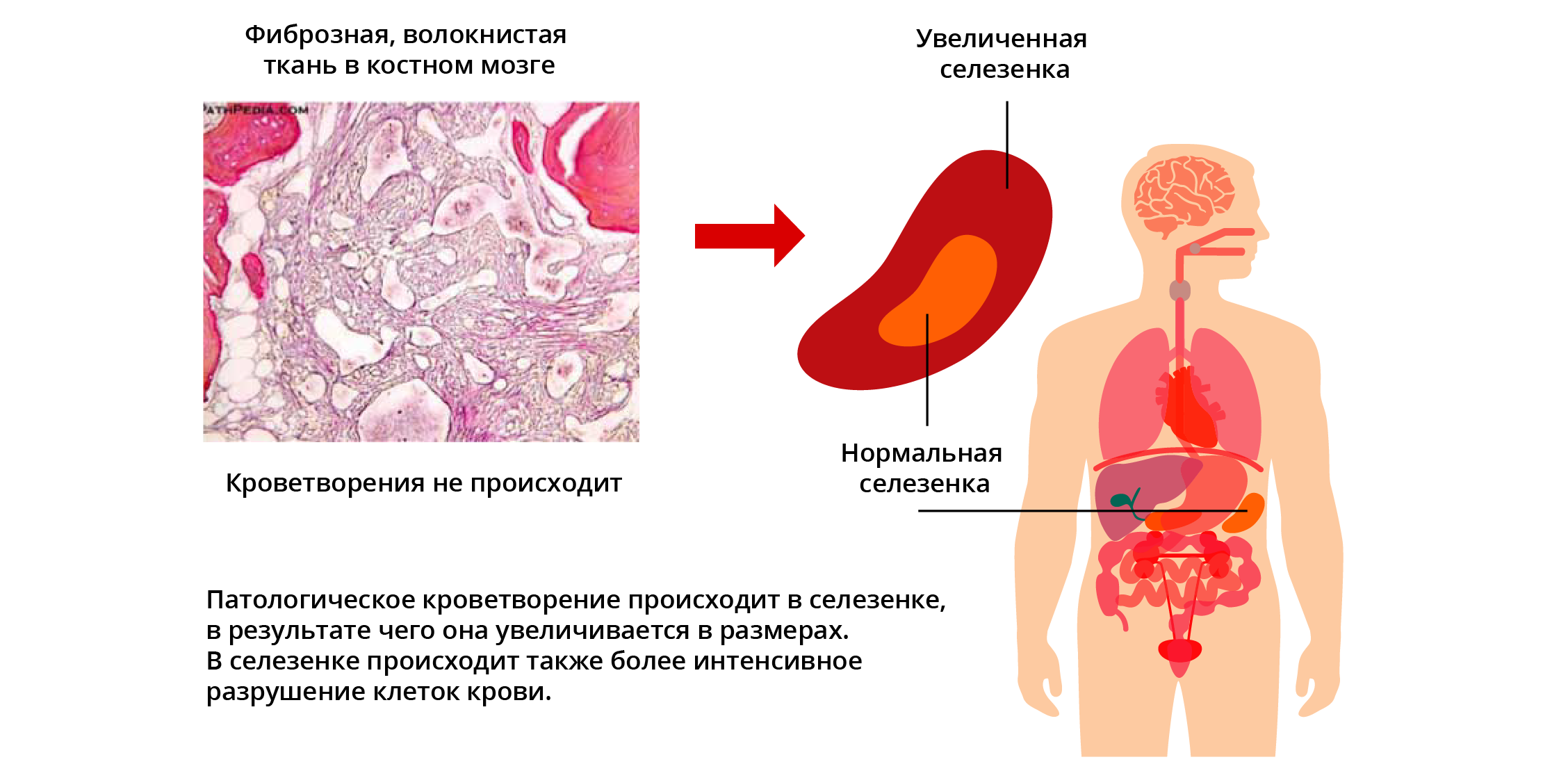
В результате этого в костном мозге происходит разрастание соединительной ткани и снижается выработка нормальных клеток крови. Постепенно развивается анемия, также может снижаться содержание тромбоцитов и лейкоцитов. Селезенка и печень могут компенсаторно перенять на себя выработку клеток крови, однако увеличение этих органов может стать причиной жалоб со стороны пациентов.
Чаще всего (примерно в 60% случаев) изменение обнаруживается в гене янус-киназы 2 (JAK2); примерно в 30% случаев изменение обнаруживают в гене кальретикулина (CALR). Реже изменение обнаруживают в гене MPL со схожим механизмом действия.
Причина генетических изменений неизвестна. Возможными факторами риска являются контакт с химикатами и ионизирующим излучением.
Миелофиброз не является наследственным заболеванием, его развитие также нельзя предупредить!
Симптомы
МФ преимущественно диагностируется на основании жалоб пациента, однако иногда болезнь может обнаруживаться случайно по изменениям в результатах анализа крови.
Чаще всего отмечаются следующие жалобы:
- вследствие анемии или малокровия — усталость, слабость, одышка (недостаток воздуха), сильное биение сердца, бледность;
- вследствие увеличения селезенки (и печени) — боль в верхней части живота, ощущение наполненности живота, снижение массы тела;
- такие общие симптомы, как увеличение потливости по ночам, повышенная температура, кожный зуд;
- вследствие недостатка белых клеток крови — частые инфекции;
- боли в костях и суставах.

У 12–25% пациентов заболевание может перейти в острый миелоидный лейкоз.
Лечение
Цель лечения состоит в облегчении симптомов, улучшении качества жизни и (по возможности) продлении жизни.
Лечение начинают при появлении симптомов. Оценить симптомы помогает опросник MPN-SAF TSS (Myeloproliferative Neoplasm Symptom Assessment Form Total Symptom Score [форма оценки симптомов миелопролиферативного новообразования — общий балл симптомов]), который можно получить для заполнения у лечащего врача или медсестры.
Пациентам без симптомов заболевания (например, без увеличения селезенки, тяжелой анемии или прочих осложнений) лечение может и не потребоваться. Стабильное состояние может сохраняться годами, однако пациент должен регулярно проверять состояние своего здоровья у гематолога. Исследования не подтвердили, что начало лечения еще до появления симптомов может как-то улучшить прогноз.
На данный момент не существует лекарств, которые могли бы полностью излечить от этого заболевания. Трансплантация стволовых клеток от другого человека (аллогенная трансплантация) — это единственный метод, потенциально излечивающий от миелофиброза. Однако его можно применять только у более молодых пациентов без существенных сопутствующих заболеваний. Таким образом, пересадка стволовых клеток подходит менее чем 5% пациентов с МФ.
Возможности для лечения
Применяемые лекарства
Ингибиторы янус-киназ (JAK) — это группа лекарств, подавляющих активность внутриклеточного сигнального пути JAK-STAT, который вызывает миелофиброз. Эти лекарства эффективно помогают уменьшить размеры селезенки и облегчить общую симптоматику, а также могут продлить жизнь.
В начале лечения может произойти усугубление анемии и снизиться число тромбоцитов, что обусловлено механизмом действия лекарств. Другие наиболее частые побочные действия: головная боль и головокружение, кровотечение и инфекции. Лечение нельзя прерывать внезапно, поскольку в таком случае симптомы болезни могут быстро вернуться.
В рамках химиотерапии применяют противоопухолевые (цитотоксичные) вещества для уничтожения опухолевых клеток. Этот метод лечения можно применять также при МФ, особенно при наличии тяжелых симптомов. Химиотерапия может помочь снизить размер селезенки и печени, а также контролировать другие симптомы. Химиотерапия подходит не каждому.
Гидроксикарбамид или гидроксимочевина — это наиболее часто и преимущественно в первую очередь применяемый химиотерапевтический препарат для уменьшения размеров селезенки и ослабления других симптомов болезни. Гидроксикарбамид пациенты ежедневно принимают дома в форме капсул. В большинстве случаев лекарство хорошо переносится. В качестве побочных действий могут отмечаться снижение числа клеток крови, кожная сыпь, язвы на ногах, тошнота и понос.
Интерферон альфа применяют при лечении МФ у пациентов более молодого возраста. Это средство схоже с веществом, которое вырабатывается и в самом организме для борьбы с инфекциями и опухолевыми клетками. Интерферон альфа преимущественно применяют у пациентов с диагностированным МФ при увеличении селезенки, боли в костях и высоком числе тромбоцитов.
Удаление селезенки
Вариант хирургического удаления селезенки рассматривают, когда другие методы лечения не помогли уменьшить симптомы, обусловленные увеличением этого органа, и когда отсутствуют противопоказания к хирургической операции.
Возможная польза от операции: ослабление симптомов, уменьшение давления во входящей в печень вене, снижение потребности в переливаниях крови.
Риски: инфекции, увеличение печени, увеличение числа тромбоцитов, риск тромбоза, непосредственно связанные с операцией осложнения.
Лечение анемии
- Периодические переливания эритроцитов ослабляют обусловленные анемией симптомы. В результате множества переливаний крови в организме может развиться хроническая перегрузка железом — избыток железа накапливается в организме, повреждая сердце и печень. Для выведения из организма избытка железа может потребоваться применение специального лекарства.
- Для повышения уровня гемоглобина при анемии можно использовать эритропоэтин. Лекарства из этой группы применяют в виде подкожных инъекций (обычно один раз в неделю). Результаты лечения лучше у пациентов с низким уровнем эритропоэтина в сыворотке, которые не зависят от переливаний крови. Наиболее часто отмечаются такие побочные действия: боль в месте инъекции, повышение артериального давления и увеличение риска тромбоза.
- Гормональная терапия глюкокортикостероидами применяется прежде всего при анемии, вызванной аутоиммунным гемолизом (когда организм вырабатывает антитела, направленные против собственных эритроцитов), но она может помочь повысить уровень гемоглобина также при негемолитической анемии. Гормональную терапию применяют также в комбинации с другими лекарствами. Наиболее частые побочные действия: тошнота, изжога, головная боль, нарушения сна и остеопороз.
Лучевая терапия
Лучевую терапию в низких дозах рассматривают как вариант для уменьшения размеров селезенки, если другие методы лечения не дали желаемых результатов. Лучевая терапия может увеличить риск инфекций. Эффект этого метода лечения является временным и в большинстве случаев сохраняется до полугода.
Прогноз
МФ не разделяют на стадии. Прогноз в контексте выживаемости оценивают индивидуально в случае с каждым пациентом. В зависимости от возраста, результатов анализа крови и общей симптоматики пациентов распределяют на группы риска (по шкалам оценки риска IPSS и DIPSS). Иногда при определении риска учитывают также потребность в переливаниях крови и изменения в хромосомах клеток (шкала оценки риска DIPPS plus). От группы риска зависит как лечение, так и прогноз. Течение болезни может быть разным, так что и ожидаемая продолжительность жизни с заболеванием может составлять от нескольких лет до > 10 лет. Результаты лечения индивидуальны и не поддаются прогнозированию.
Составители: члены рабочей группы Эстонского общества гематологов по миелопролиферативным опухолям д-р Марге Раху \[Marge Rahu], д-р Халлики Кыдар \[Halliki Kõdar], д-р Марис Пярнат \[Maris Pärnat], д-р Креэте Ильвес \[Kreete Ilves] и д-р Мирья Варик \[Mirja Varik]. При поддержке компании Novartis.

